 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
对于可逆反应:PCI5(g)=PCl3(g)+Cl2(g),下列说法正确的是()
A.恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动
B.升高温度,反应速度加快,PCl5的分解率增大
C.减小总压力,反应速度减慢,PCl5转化率降低
D.降低温度,PCl5的分解率降低,此反应为吸热反应
 答案
答案
D、降低温度,PCl5的分解率降低,此反应为吸热反应
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.恒温下,增大压力,由于产物分子数多,Kc值减小,平衡逆向移动
B.升高温度,反应速度加快,PCl5的分解率增大
C.减小总压力,反应速度减慢,PCl5转化率降低
D.降低温度,PCl5的分解率降低,此反应为吸热反应
 答案
答案
D、降低温度,PCl5的分解率降低,此反应为吸热反应
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“对于可逆反应:PCI5(g)=PCl3(g)+Cl2(g),…”相关的问题
更多“对于可逆反应:PCI5(g)=PCl3(g)+Cl2(g),…”相关的问题
A.放热反应;
B.吸热反应;
C.既不放热也不吸热;
D.这两个温度下的平衡常数相等
PCI5的分解反应为: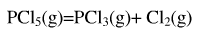 。在523.2K,101.325kPa下反应达到平衡后,测得平衡混合物的密度为2.695×103kg·m-3,试计算:
。在523.2K,101.325kPa下反应达到平衡后,测得平衡混合物的密度为2.695×103kg·m-3,试计算:
(1) PCI5(g)的解离度;(2) 该反应的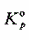 ;(3)该反应的
;(3)该反应的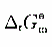 。
。
A.气体密度保持不变
B.压强保持不变的状态
C.断裂2mol H-I键的同时生成1mol I-I键
D.混合气体的颜色不再变化时
A.H2的消耗速率与HI的生成速率之比为2:1
B.若平衡正向移动,则V正一定增大
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等
五氯化磷分解反应为PCl5(g)=PCl3(g)+Cl2(g)。200℃时KΘ=0.312。计算(1)在200℃、200kPa条件下PCl5的解离度;(2)组成为1:5的PCl5和Cl2混合气体在200℃、100kPa条件下PCl5的解离度。
A.在298K时,H2O(1)和H2O(g)共存
B.S(s),S(I)和S(g)平衡
C.C2HsOH(I)和H2O(1)的混合物
D.一定量的PCl5(g)分解平衡时,PCl5(g)=PCl3(g)+Cl2(g)
A.增大压力
B.增大D的浓度
C.使用催化剂
D.升高温度
A.热化学方程式中化学计量数表示分子数
B.该反应ΔH2大于零
C.该反应ΔH2=-571.6 kJ·mol-1
D.该反应与上述反应属于可逆反应