 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位:mol·dm-3,压力单位:101.
325kPa).
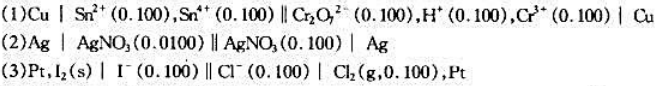
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
325kPa).
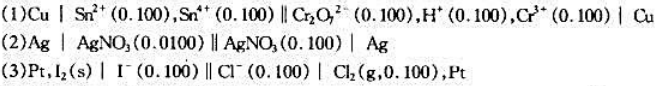
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位…”相关的问题
更多“求下列电池的电动势,并写出该电池放电时的反应方程式(浓度电位…”相关的问题
电池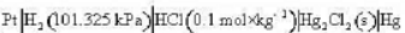 电动势召与温度T的关系为
电动势召与温度T的关系为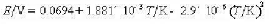
(1)写出电池反应:(2)计算25°C时该反应的DrCm.DrSm.DrHm以及电池恒温可逆放电时该反应过程的Qr.m
一个可逆电动势为1.07V的原电池,在恒温槽中恒温至293K,当此电池短路(即直接发生化学反应,不做电功)时有1000C的电荷量通过。假定电池中发生的反应与可逆放电时的反应相同,试求以此电池和恒温槽都看做系统时总的熵变。如果要分别求算恒温槽和电池的熵变,还需何种数据?
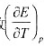
为1.40x10-4V/K。
已知铅酸蓄电池
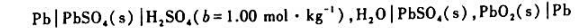
在25°C时的电动势E=1.9283V,Eθ=2.0501V.该电池的电池反应为
Pb(s)+PbO2(s)+2SO42-+4H+→2PbSO4(s)+2H2O
(1)请写出该电池的电极反应;
(2)计算该电池中硫酸溶液的活度a、平均离子活度az及平均离子活度因子γz;
(3) 已知该电池的温度系数为5.664x10-5V·K-1,计算电池反应的ΔrGm,ΔrSm,ΔrHm,
及可逆热Qr,m.
已知下列电池在25℃时的电动势为0.125V,求算cCu2+。
(—)Cu|Cu2+(1.0×10-4mol·L-1)||Cu2+(c)|Cu()
25℃时测得下列电池的电动势为0.622V,求配合物Ag(CN)2-的稳定常数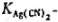 。(已知
。(已知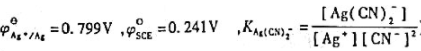 )
)
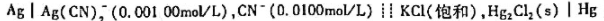
在某一银一金合金中银的摩尔分数为0.400,将此合金用于电池Ag|AgCl(固)|Ag-Au中,在200℃时测得电池的电动势为0.0864V,求该合金中Ag的活度及活度系数。
已知

Cd|Cd2+(0.10mol·L-1)||Sn4+(0.10mol·L-1),Sn2+(0.0010mol·L-1)|Pt在298K时的电动势ε,并写出电池反应,标明正、负极。
用Cl-选择性电极作负极,SCE作正极组成电池,测定某溶液中氯化物的含量。取100mL此溶液在25℃时测得电池电动势为28.8mV,加入1.00mL浓度为0.475mol·L-1的经酸化的NaCl标准溶液后,测得电池电动势为53.5mV。求该溶液中氯化物的浓度(mol·L-1)。