 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
由标准钴电极和标准氯电极组成原电池,测得其电动势为1.64 V,此时钴电极为负极。已知氯电极的标准
电极电位为1.36 V,试求: (1)写出该电池的反应方程式。 (2)计算钴电极的标准电极电位。 (3)当氯气压力增大时,电池的电动势是增大还是减小? (4)当c(Co2+)=0.01 mol.dm-3,计算电池的电动势。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“由标准钴电极和标准氯电极组成原电池,测得其电动势为1.64 …”相关的问题
更多“由标准钴电极和标准氯电极组成原电池,测得其电动势为1.64 …”相关的问题
由标准钴电极(Co2+/Co)与标准氯电极组成原电池,测得其电动势为1.64V,此时钴电极为负极。已知 (Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
(Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
某学生为测定CuS的溶度积常数,设计如下原电池:正极为铜片,在0.1mol·dm-3Cu2+的溶液中,再通入H2S气体使之达到饱和;负极为标准锌电极。测得电池电动势为0.670V。已知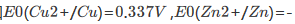 0.763V,H2S的
0.763V,H2S的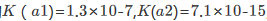 。试求CuS的溶度积常数。
。试求CuS的溶度积常数。
测定柠檬汁中氯化物含量时,用氯离子选择性电极和参比电极在100mL柠檬汁中测得电动势为-37.5mV,加入1.00mL1.0×10-2mol·L-1NaCl标准溶液,测得电动势为-64.9mV。已知MCl=35.45g·mol-1。计算柠檬汁中氯的含量,以mg·L-1表示。
以Ag/AgC1与铜离子选择性电极组成下列电池饱和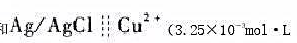
 铜离子选择性电极
铜离子选择性电极
在25℃时,测得电池的电动势为0.124V。若用未知铜活度的溶液取代上述电池中Cu2+(3.25X10-3mo1•L-1)的溶液,测得其电动势为0.086V。计算未知液中pCu(不考虑液接电位)。