 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
在298K和标准状态时,下列反应均为非自发反应,其中在高温时仍为非自发的反应是( )。
在298K和标准状态时,下列反应均为非自发反应,其中在高温时仍为非自发的反应是()。
A.Ag2O(s)=2Ag(s)+ O2(g)
O2(g)
B.N2O2=2NO2(g)
C.6C(s)+6H2O(g)=C6H12O6(s)
D.Fe2O3(s)+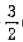 C(s)=2Fe(s)+
C(s)=2Fe(s)+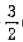 CO2g
CO2g
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在298K和标准状态时,下列反应均为非自发反应,其中在高温时…”相关的问题
更多“在298K和标准状态时,下列反应均为非自发反应,其中在高温时…”相关的问题
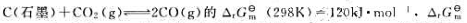 (1000K)=-3.4kJ·mol-1,计算(1) 在标准状态及温度分别为298K和1000K时的标准平衡常数;(2)当1000K时,p(CO)=200kPa,p(CO2)=800kPa,判断该反应方向。
(1000K)=-3.4kJ·mol-1,计算(1) 在标准状态及温度分别为298K和1000K时的标准平衡常数;(2)当1000K时,p(CO)=200kPa,p(CO2)=800kPa,判断该反应方向。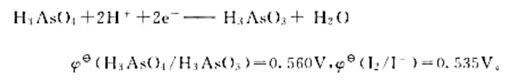
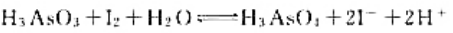
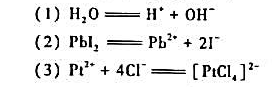
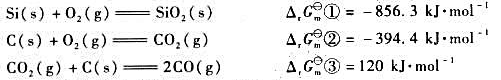
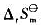 ,进一步计算该反应进行的最低温度要求。
,进一步计算该反应进行的最低温度要求。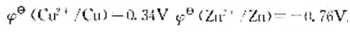 ,求此时原电池的电动势比标准状态时的电动势()
,求此时原电池的电动势比标准状态时的电动势()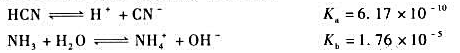
 在该温度下的平衡常数。
在该温度下的平衡常数。
 :
: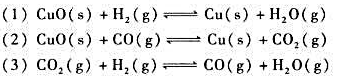
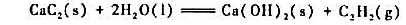
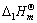 。
。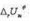 和
和

















