 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知反应在298K时=-128.0kJ·mol-1,试计算298K时的。
已知反应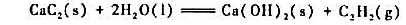
在298K时=-128.0kJ·mol-1,试计算298K时的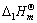 。
。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应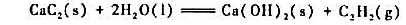
在298K时=-128.0kJ·mol-1,试计算298K时的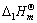 。
。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知反应在298K时=-128.0kJ·mol-1,试计算2…”相关的问题
更多“已知反应在298K时=-128.0kJ·mol-1,试计算2…”相关的问题
植物在光合作用中合成葡萄糖的反应可以近似表示为:
6CO2(g)+6H2O(1)=C6H12O6(s)+6O2(g)
计算反应的标准摩尔吉布斯自由能,判断反应在298K及标准状态下能否自发进行,已知葡萄糖的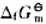 (C6H12O6·s) =-910.5kJ·mol-1。
(C6H12O6·s) =-910.5kJ·mol-1。
已知电极反应:
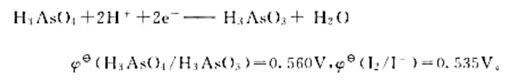
计算下列反应:
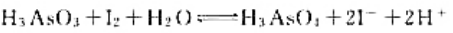
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
A.△rH>0△rS>0
B.△rH>0△rS<0
C.△rH<0△rS<0
D.△rH>0△rS>0
已知反应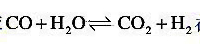 在700K时的平衡常数Kp=9,反应开始时系统中含有H2O、CO2、H2各1kmol,试求平衡组成.
在700K时的平衡常数Kp=9,反应开始时系统中含有H2O、CO2、H2各1kmol,试求平衡组成.
已知298K时,Ca(OH)2(s)的 =-897.5kJ·mol-1,H2O(1)的
=-897.5kJ·mol-1,H2O(1)的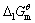 =-237.1kJ·mol-1,
=-237.1kJ·mol-1,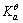 = 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
= 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
A.v=kc2(CH3COCH3)c(H+)
B.v=kc(CH3COCH3)c(H+)
C.v=kc(CH3COCH3)c(l2)
D.v=kc(CH3COCH3)c2(l2)
已知反应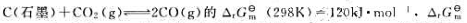 (1000K)=-3.4kJ·mol-1,计算(1) 在标准状态及温度分别为298K和1000K时的标准平衡常数;(2)当1000K时,p(CO)=200kPa,p(CO2)=800kPa,判断该反应方向。
(1000K)=-3.4kJ·mol-1,计算(1) 在标准状态及温度分别为298K和1000K时的标准平衡常数;(2)当1000K时,p(CO)=200kPa,p(CO2)=800kPa,判断该反应方向。