 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
固态化合物分解反应达到平衡时,产物气体的()称为该化合物的分解压力。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“固态化合物分解反应达到平衡时,产物气体的()称为该化合物的分…”相关的问题
更多“固态化合物分解反应达到平衡时,产物气体的()称为该化合物的分…”相关的问题
将足量的固态氨基甲酸氨(NH2COONH4)放在抽空容器内恒温下发生分解反应并达平衡:

则此平衡系统的组分数C=().相数P=(),自由度F=().
A.升温加压
B.升温降压
C.降温加压
D.降温降压
将向();当加大总压力时,平衡向();当升高温度时,平衡向()。
A.增大
B.减小
C.不变
D.增大或减小
五氧化二磷(PCI3)分解反应
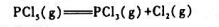
在200℃时的K°=0.312,计算:
(1)200℃,200kPa下PCI3的解离度;
(2)摩尔比为1:5的PCI3与CI2的混合物,在200℃,100kPa下达到平衡时PCI3的解高度.
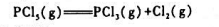
指出下列平衡系统中的组分数C,相数P及自由度F.
(1)l2(s)与其蒸气成平衡:
(2)MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡;
(3)NH4CI(s)放入一抽空的容器中,与其分解产物NH3(g)和HCI(g)成平衡;
(4)任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡;
(5)过量的NH4HCO3(s)与其分解产物NH3(g),H2O(g)和CO2(g)成平衡;
(6)I2作为溶质在两不互溶液体H2O和CCI4中达到分配平衡(凝聚系统).
在高温下HgO按下式分:
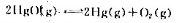
在450℃时所生成的两种气体的总压力为108.0 kPa,在420℃时分解总压力是51.6 kPa。
(1)计算在450oC和420oC时的标准平衡谐数 以及在450℃和420℃时p(O2),p(Hg)各为多少?由此推断,该反应是吸热反应还是故热反应?
(2)如果将10.0g HgO放在1.0dm3的容器中,温度升高至450℃,问有多少克HgO没有分解?
题目来源:1月7日下午山西省大同市面试考题
试讲题目
1.题目:化学平衡
2.内容:
二、化学平衡状态
如果把溶质《不限于固体)在溶液中形成饱和溶被时的状态。称为溶解平衡状态,对于化学反应体系来说,就应当称作化学平衡状态。容解平衡所具有的许多特点,在:化学平衡体系中都可以找到。例如。在反应体系中同时存在着正、道反应两个过程,当这两个过程的速率不相等时,常常只能观购到某个力向的变化。
在一定条件下,当正、逆两个方向的反应速率相等时,反应体系中所有参加反应的物质的质量或浓度可以保持恒定。这时的状态也就是在给定条件下,反应达到了“限度”。对于可逆反应体系来说。我们称之为“化学平衡状态"。这时正、逆变化过程虽然仍在继续,如果不采用特殊的方法或技术,实际观察到的是一种“反应停止了”的表观现象。由此我们可以总结出以下的认识:
1.构成化学平衡体系的基本要求是:反应物和所有产物均处于同一反应体系中,反应条件(如温度、压强等)保持不变。
2.达到化学平衡状态时,体系中所有反应物和生成物的质量(或浓度)保持不变。但是这个体系中的反应并没有停止。只是正、逆反应的速率相等。
我们知道,不同湖度下物质的溶解度不同。那么,t0时达到溶解平衡状态的饱和溶液,当升高或降低温度至t1时,溶解与结晶的速率不再相等。溶解平衡状态被打破,表现为固体溶质继续溶解或析出,直至溶解与结晶的速率再次相等,达到t1下新的溶解平衡状态。
那么化学平衡是否也只有在一定的条件下才能保持?当一个可逆反应达到化学平衡状态后,如果改变浓度,压强。温度等反应条件,平衡状态是否也会发生变化?
有人认为,如果把那些能够进行到底的化学反应体系也看作是可逆性的,亦即相当于正反应的限度接近100%。逆反应的限度几乎等于0的一种情况,就可以把这两类看来似乎迥然不同的反应统一起。不过在定义可逆反应时,有一个必要的前提。那就是,反应物和产物必需同时存在于同一反应体系中,而且在相同条件下,正、逆反应都能够自动进行,不能满足这个前提的化学反应体系,就不能认为是可逆性的。
化学平衡:chemical equilibrium
3.基本要求:
(1)要有适当的情境创设。
(2)教学过程中要有课堂互动环节。
(3)请在十分钟内完成试讲。