 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
温度T下,CaCO3(s)发生的分解反应CaCO3(s)=CaO(s)+CO2(g),平衡系统的压力为p,若向该平衡系统中加入CO2(g),达到新平衡时系统的压力将().
温度T下,CaCO3(s)发生的分解反应CaCO3(s)=CaO(s)+CO2(g),平衡系统的压力为p,若向该平衡系统中加入CO2(g),达到新平衡时系统的压力将().
A.增大
B.减小
C.不变
D.增大或减小
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“温度T下,CaCO3(s)发生的分解反应CaCO3(s)=C…”相关的问题
更多“温度T下,CaCO3(s)发生的分解反应CaCO3(s)=C…”相关的问题
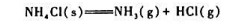
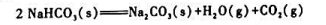
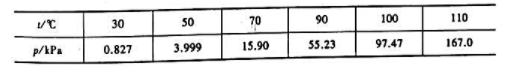
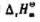 与温度无关.求:
与温度无关.求: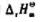 ;
;
















