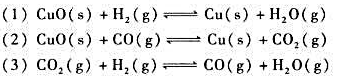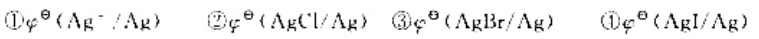更多“计算298K时下列各电对的电极电势:”相关的问题
更多“计算298K时下列各电对的电极电势:”相关的问题
第1题
已知下列电对的标准电极电势:在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1
已知下列电对的标准电极电势:
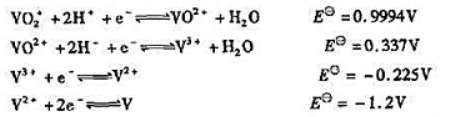
在酸性溶液中分别用1.0mol·L-1Fe2+,1.0mol·L-1Sn2+和Zn还原1.0mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?
第2题
已知298K时,Ca(OH)2(s)的=-897.5kJ·mol-1,H2O(1)的=-237.1kJ·mol-1,= 1.
已知298K时,Ca(OH)2(s)的=-897.5kJ·mol-1,H2O(1)的=-237.1kJ·mol-1,= 1.
点击查看答案
已知298K时,Ca(OH)2(s)的 =-897.5kJ·mol-1,H2O(1)的
=-897.5kJ·mol-1,H2O(1)的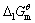 =-237.1kJ·mol-1,
=-237.1kJ·mol-1,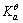 = 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
= 1.00×10-7,试求电对Ca(OH)2/Ca的电极电势。
第4题
已知下列各反应298K时的自由能改变量: (1)试通过计算说明,制备单质Si的反应: SiO2(s)+2
已知下列各反应298K时的自由能改变量: (1)试通过计算说明,制备单质Si的反应: SiO2(s)+2
点击查看答案
已知下列各反应298K时的自由能改变量:
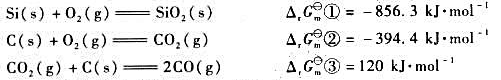
(1)试通过计算说明,制备单质Si的反应:
SiO2(s)+2C(s)=Si(s)+2CO(g)
在常温下不能自发进行。
(2)查热力学数据表,计算上述制备反应的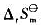 ,进一步计算该反应进行的最低温度要求。
,进一步计算该反应进行的最低温度要求。
第8题
将电对和电对的电势-pH图画在同一直角坐标系中。指出体系中涉及的歧化反应和逆歧化反应发生的
将电对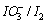 和
和 电对的电势-pH图画在同一直角坐标系中。指出体系中涉及的歧化反应和逆歧化反应发生的具体pH范围。若在298K,pH=11时将所发生的反应以原电池方式完成,试计算原电池的电动势E和电池反应的
电对的电势-pH图画在同一直角坐标系中。指出体系中涉及的歧化反应和逆歧化反应发生的具体pH范围。若在298K,pH=11时将所发生的反应以原电池方式完成,试计算原电池的电动势E和电池反应的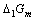 。
。
第9题
已知Fe3+/Fe2+,Cu2+/Cu,Sn4+/Sn2+,Fe2+/Fe等各电对的标准电极电势分别为0.77V、0.34V、0.15V、-0.41V,则在标准状态下,最强的氧化剂和最强的还原剂分别是()。
A.Fe3+和Cu
B.Fe2+和Sn2+
C.Cu2+和Fe
D.Fe3+和Fe
第10题
已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应
已知电极反应:
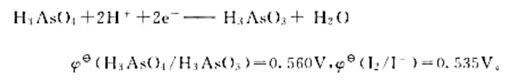
计算下列反应:
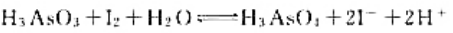
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?

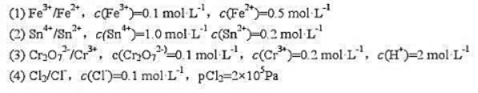

 如果结果不匹配,请
如果结果不匹配,请 
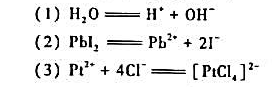

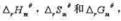
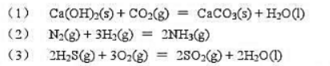

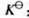 :
: