 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知M2+离子3d轨道中有5个d电子,请推出:(1)M原子的核外电子排布式;(2)M原子的最外层和最高能级组中电子数;(3)M元素在周期表中的位置。
已知M2+离子3d轨道中有5个d电子,请推出:(1)M原子的核外电子排布式;(2)M原子的最外层和最高能级组中电子数;(3)M元素在周期表中的位置。
此题为判断题(对,错)。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
此题为判断题(对,错)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知M2+离子3d轨道中有5个d电子,请推出:(1)M原子的…”相关的问题
更多“已知M2+离子3d轨道中有5个d电子,请推出:(1)M原子的…”相关的问题
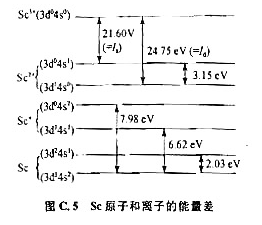
图C.5列出Sc原子和离子的能量差,请回答或据此解答下列问题:
(1)Sc原子的3d和4s电子结合能;
(2)Sc原子的电子互斥能J(s,s),J(d,s)和J(d,d);
(3)Sc原子的3d和4s单电子轨道能;
(4)讨论价电子的增填次序和电离次序。
OH分子于1964年在星际空间被发现。
(1)试按分子轨道理论只用O原子的2p轨道和H原子的1s轨道叠加,写出其电子组态;
(2)在哪个分子轨道中有不成对电子?
(3)此轨道是由O和H的原子轨道叠加形成,还是基本上定域于某个原子上?
(4)已知OH的第一电离能为13.2eV,HF的第一电离能为16.05eV,它们的差值几乎和O原子与F原子的第一电离能(15.8eV和18.6eV)的差值相同,为什么?
(5)写出它的基态光谱项。
某阳离子M2+可形成[MCl4]2-配离子,其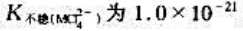 ,MI2的Ksp为1.0×10-15,请计算在1L溶液中,欲使0.010molMI2溶解,需Cl-的摩尔量.
,MI2的Ksp为1.0×10-15,请计算在1L溶液中,欲使0.010molMI2溶解,需Cl-的摩尔量.
A.中心离子和配位体与配位键结合,其中配体的配原子提供孤对电子是电子的供体,中心离子提供容纳孤对电子的空轨道是电子的受体中心离子必须具有适当的空轨道
B.为增加成键能力,中心原子中能量相近的几个空轨道进行杂化,形成相同数目的,或者是能量相等,并且有一定方向性的杂化轨道
C.配离子的空间结构、配位数以及稳定性主要取决于杂化轨道的数目和类型
D.杂化轨道的数目和类型包括外轨型配合物中心原子使用外层的ns、np和nd轨道进行杂化