 更多“已知下列反应的值:试计算用H2还原和时的及.”相关的问题
更多“已知下列反应的值:试计算用H2还原和时的及.”相关的问题
已知反应:

298K时的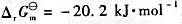 。试计算:
。试计算:
(1)该反应的标准平衡常数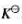 ;
;
(2)若空气中H2S的分压为3.1Pa,试计算可以确保铜单质免遭H2S腐蚀时H2的分压。
下图表示生成几种氯化物反应的
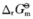 随温度变化情况,试回答:
随温度变化情况,试回答:
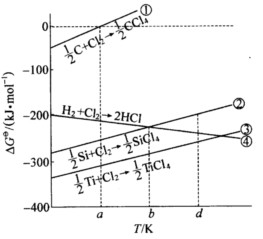 (1)反应①在温度a时,
(1)反应①在温度a时,
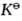 等于多少? (2)反应②是吸热反应还是放热反应?为什么? (3)反应④是熵增反应还是熵减反应?为什么? (4)在温度a时,Ti能否从SiCl4中置换出Si?为什么? (5)在温度d时能否用H2还原SiCl4制备Si?温度低于b时又怎么样?
等于多少? (2)反应②是吸热反应还是放热反应?为什么? (3)反应④是熵增反应还是熵减反应?为什么? (4)在温度a时,Ti能否从SiCl4中置换出Si?为什么? (5)在温度d时能否用H2还原SiCl4制备Si?温度低于b时又怎么样?
已知反应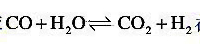 在700K时的平衡常数Kp=9,反应开始时系统中含有H2O、CO2、H2各1kmol,试求平衡组成.
在700K时的平衡常数Kp=9,反应开始时系统中含有H2O、CO2、H2各1kmol,试求平衡组成.
在1 000 K时,实验测得气相反应C2H5(g)→2CH3. 的速率常数表达式为k/s-1=2.0×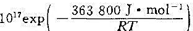 ,设这时
,设这时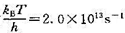 。(1)试计算反应的半衰期t1/2;(2)试计算C2H6(g)分解反应的活化熵
。(1)试计算反应的半衰期t1/2;(2)试计算C2H6(g)分解反应的活化熵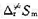 ;(3)已知1000 K时该反应的标准熵变
;(3)已知1000 K时该反应的标准熵变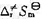 =74.1
=74.1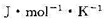 ,试将此值与(2)中所得的
,试将此值与(2)中所得的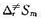 值比较,定性地讨论该反应的活化配合物的性质。
值比较,定性地讨论该反应的活化配合物的性质。
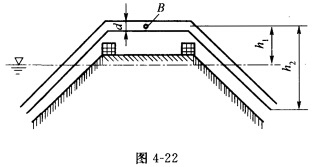
(武汉大学2009年考研试题)如图4-22所示为用虹吸管越堤引水。已知管径d=0.2m,h1=2m,h2=4m。不计水头损失,取动能修正系数为1。试求。(1)虹吸管的流量Q;(2)设允许最大真空值为7m水头,B点的真空压强是否超过最大允许值?
下图所示为一卷扬机的传动装置,试计算卷扬机能够提升的最大重力FW。已知电动机转速n1=960r/min,卷简直径D=250mm,齿轮齿数z1=z3=23,z2=z4=115,齿轮模数m=4mm,齿轮材料为45钢,小齿轮调质,大齿轮正火,其许用应力值为[σ]H1=[σ]H3=550MPa,[σ]H2=[σ]H4=400MPa,[σ]F1=[σ]F3=250MPa,[σ]F2=[σ]F4=200MPa,齿轮宽度b1=b3=80mm,b2=b4=75mm。
齿轮强度计算公式为
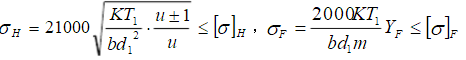
式中,YF1=YF3=2.68,YF2=Yf4=2.18;K=1.3。
注:T1的单位符号为N·m。(忽略传动系统的磨损损失)
298.15K,1x10-3m3容器中的压力值,并与用理想气体状态方程计算的压力值进行比较.
已知下列各反应298K时的自由能改变量:
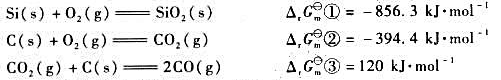
(1)试通过计算说明,制备单质Si的反应:
SiO2(s)+2C(s)=Si(s)+2CO(g)
在常温下不能自发进行。
(2)查热力学数据表,计算上述制备反应的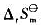 ,进一步计算该反应进行的最低温度要求。
,进一步计算该反应进行的最低温度要求。
已知反应CO2(g)+H2(g)=CO(g)+H2O(g)在973K时的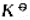 =0.618.若系统中各组分气体分压为p(CO2)=p(H2)=127kPa,p(CO)=p(H2O)=76kPa,计算此时
=0.618.若系统中各组分气体分压为p(CO2)=p(H2)=127kPa,p(CO)=p(H2O)=76kPa,计算此时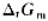 (973K)时值并判断反应进行的方向。
(973K)时值并判断反应进行的方向。
密闭容器中的反应CO(g)+H2O(g)=CO2(g)+H2(g)在750K时其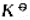 =2.6,试计算:
=2.6,试计算:
(1)当原料气中H2O(g)和CO(g)的物质的量之比为1:1时,CO(g)的转化率为多少?
(2)当原料气中H2O(g)和CO(g)的物质的量之比为4:1时,CO(g)的转化率为多少 ? 说明什么问题?

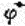 值:
值: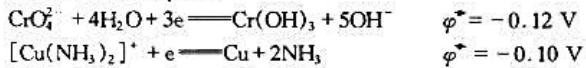
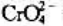 和
和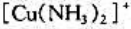 时的及
时的及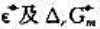 .
.
 如果结果不匹配,请
如果结果不匹配,请 

















