 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知某酸在水溶液中发生分解反应。当温度为650K时,反应速率常数为2.0×10-5s-1;670K
时,反应速率常数为7.0×10-5s-1,试计算这个反应的活化能。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知某酸在水溶液中发生分解反应。当温度为650K时,反应速率…”相关的问题
更多“已知某酸在水溶液中发生分解反应。当温度为650K时,反应速率…”相关的问题
A.Kp① >Kp②
B.Kp①
C.Kp①=Kp②
D.无法确定
A、纯碱可以与酸反应生成盐和二氧化碳
B、重质纯碱的密度比轻质纯碱的密度大
C、纯碱可以与氯化钙反应生成白色沉淀
D、重质纯碱的安息角为45°
E、纯碱水溶液可以用来除粗盐水中的钙杂质
F、纯碱灼烧时产生分解现象,放出二氧化碳
已知四氧化二氮的分解反应如下:

在298.15K时,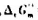 =4.75kJ·mol-1.试判断在此温度及下列条件下,反应进行的方向.
=4.75kJ·mol-1.试判断在此温度及下列条件下,反应进行的方向.
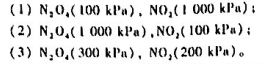
反应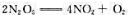 在某温度时速率系数为2.31×10-3s-1,计算:
在某温度时速率系数为2.31×10-3s-1,计算:
(1)反应进行了10min后,N2O5分解的百分率;
(2)N2O,分解反应的半衰期。
A.电容器外壳膨胀、严重渗油、内部有异音及外部有火花时
B.因电容器组投入而引起电压升高超过规定范围时
C.室内温度超过制造厂规定时,若无制造厂规定,当室内温度超过35℃
D.室内温度超过制造厂规定时,若无制造厂规定,当室内温度超过25℃
A.在溶液中加入一定量的KNO3溶液,难溶电解质溶解度增加
B.当某条件下IP=Ksp时,表示溶液是饱和的,沉淀和溶解达到动态平衡
C.在溶液中加入少量的NaCl溶液,可使溶解度减少
D.根据溶度积规则,沉淀生成条件是IP>Ksp
E.一定温度下,对于不同类型的难溶电解质来说,Ksp越大,溶解度越大
F.难溶性电解质在水溶液中都无法解离G、AgCl水溶液的导电性很弱,所以AgCl为弱电解质