 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用KMnO4标准溶液滴定Fe2+的反应为:试计算:①该反应的平衡常数;②为使反应完全定量进行
用KMnO4标准溶液滴定Fe2+的反应为:

试计算:①该反应的平衡常数;②为使反应完全定量进行(Fe2+≤10-3[Fe3+]),所需的最低[H+]是多少?(已知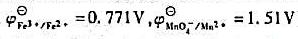 )
)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用KMnO4标准溶液滴定Fe2+的反应为:

试计算:①该反应的平衡常数;②为使反应完全定量进行(Fe2+≤10-3[Fe3+]),所需的最低[H+]是多少?(已知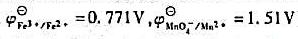 )
)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用KMnO4标准溶液滴定Fe2+的反应为:试计算:①该反应的…”相关的问题
更多“用KMnO4标准溶液滴定Fe2+的反应为:试计算:①该反应的…”相关的问题
计算在1mol·L-1H2SO4介质中,用KMnO4滴定Fe2+的条件平衡常数及化学计量点的反应进行程度。(已知:MnO 4- /Mn 2+电极电位=1.45V,Fe 3+ /Fe 2+电极电位=0.68V)
在酸性溶液中用高锰酸钾法测定Fe2+时,KMnO4溶液的浓度是0.02484mol·dm-3。求用(1) Fe;(2) Fe2O3;(3) FeSO4·7H2O表示的滴定度。
一定量的纯(NH4)2Fe(SO4)2•6H2O样品可析出BaSO4沉淀1.041g,若同样重量的样品,用KMnO4标准溶液滴定,则需消耗KMnO4标准溶液多少亳升?已知每1mL高锰酸钾标准溶液相当于0.006305gH2C2O4•2H2O。
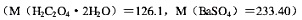
A.c(FeSO4)=c(H2C2O4)
B.2c(FeSO4)=c(H2C2O4)
C.c(FeSO4)=2c(H2C2O4)
D.2n(FeSO4)=n(H2C2O4)
称取2.200g KHC2O4·H2C2O4·2H2O配制于250mL容量瓶中,移取25.00mL,用NaOH滴定消耗24.00mL;移取25.00mL,于酸性介质中用KMnO4滴定消耗30.00mL,求此NaOH和KMnO4溶液的浓度。若用此KMnO4标准溶液测定样品中Fe含量,称取0.6000g样品消耗KMnO421.00mL,求算样品中Fe2O3的质量分数。