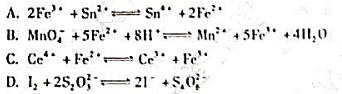题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)为多少?(a)在1mol·L-1HCL介
下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)为多少?
(a)在1mol·L-1HCL介质中,用Ce4+滴定Sn2+;
(b)在1mol·L-1H2SO4介质中,用Fe3+滴定UIV;
(c)在lmol·L-1H2SO4介质中,用Ce4+滴定vo2+.
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)…”相关的问题
更多“下列体系电位滴定至化学计量点时的电池电动势(用SCE作负极)…”相关的问题
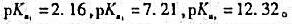 若用0.10mol/L的HCl溶液滴定0.10mol/L的Na3PO4溶液,则滴定到第二个化学计量点时体系的pH=()。
若用0.10mol/L的HCl溶液滴定0.10mol/L的Na3PO4溶液,则滴定到第二个化学计量点时体系的pH=()。