 更多“任何一个可逆的化学反应当达到平衡时各反应物和生成物的浓度相等…”相关的问题
更多“任何一个可逆的化学反应当达到平衡时各反应物和生成物的浓度相等…”相关的问题
题目来源:1月7日下午山西省大同市面试考题
试讲题目
1.题目:化学平衡
2.内容:
二、化学平衡状态
如果把溶质《不限于固体)在溶液中形成饱和溶被时的状态。称为溶解平衡状态,对于化学反应体系来说,就应当称作化学平衡状态。容解平衡所具有的许多特点,在:化学平衡体系中都可以找到。例如。在反应体系中同时存在着正、道反应两个过程,当这两个过程的速率不相等时,常常只能观购到某个力向的变化。
在一定条件下,当正、逆两个方向的反应速率相等时,反应体系中所有参加反应的物质的质量或浓度可以保持恒定。这时的状态也就是在给定条件下,反应达到了“限度”。对于可逆反应体系来说。我们称之为“化学平衡状态"。这时正、逆变化过程虽然仍在继续,如果不采用特殊的方法或技术,实际观察到的是一种“反应停止了”的表观现象。由此我们可以总结出以下的认识:
1.构成化学平衡体系的基本要求是:反应物和所有产物均处于同一反应体系中,反应条件(如温度、压强等)保持不变。
2.达到化学平衡状态时,体系中所有反应物和生成物的质量(或浓度)保持不变。但是这个体系中的反应并没有停止。只是正、逆反应的速率相等。
我们知道,不同湖度下物质的溶解度不同。那么,t0时达到溶解平衡状态的饱和溶液,当升高或降低温度至t1时,溶解与结晶的速率不再相等。溶解平衡状态被打破,表现为固体溶质继续溶解或析出,直至溶解与结晶的速率再次相等,达到t1下新的溶解平衡状态。
那么化学平衡是否也只有在一定的条件下才能保持?当一个可逆反应达到化学平衡状态后,如果改变浓度,压强。温度等反应条件,平衡状态是否也会发生变化?
有人认为,如果把那些能够进行到底的化学反应体系也看作是可逆性的,亦即相当于正反应的限度接近100%。逆反应的限度几乎等于0的一种情况,就可以把这两类看来似乎迥然不同的反应统一起。不过在定义可逆反应时,有一个必要的前提。那就是,反应物和产物必需同时存在于同一反应体系中,而且在相同条件下,正、逆反应都能够自动进行,不能满足这个前提的化学反应体系,就不能认为是可逆性的。
化学平衡:chemical equilibrium
3.基本要求:
(1)要有适当的情境创设。
(2)教学过程中要有课堂互动环节。
(3)请在十分钟内完成试讲。
将向();当加大总压力时,平衡向();当升高温度时,平衡向()。
题目来源:1月6日上午河南省濮阳市面试考题
试讲题目
1.题目:质量守恒定律
2.内容:
探究反应前后物质的质量关系
当物质发生化学反应生成新物质时,反应物的质量总和与生成物的质量总和相比较,存在什么关系?
根据以下实验方案分组进行实验,并将实验结果填入表中。
请你在实验中观察和探究以下问题,并结合条件思考和作出分析:
(1)反应物和生成物的状态及其他变化;
(2)实验中观察到的质量变化情况。

方案一:在底部铺有细沙的锥形瓶中,放入一小堆干燥的玻璃管红磷。在锥形瓶口的橡胶塞上安装一根玻璃管,在其上端系牢红磷一个小气球,并使玻璃管下端能与红磷接触。将锥形瓶和玻璃管放在托盘天平上用砝码平衡,记录所称的质量m1。然后,取下锥形瓶,将橡胶塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡胶塞将锥形瓶塞紧,并将红磷引燃。待锥形瓶冷却后,重新放到托盘天平上,记录所称的质量m2。

方案二:在锥形瓶中加入适量稀硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的锥形瓶和铁钉一起放在托盘天平上称量,记录所称的质量m1。将铁钉浸在硫酸铜溶液中,观察实验现象。待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和铁钉的锥形瓶放在托盘天平上称量,记录所称的质量m2。比较反应前后的质量。

铁与硫酸铜的反应可表示如下:

讨论:分析两个方案的实验结果,你得到什么结论?
大量实验证明,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。
3基本要求:
(1)配合教学内容要有适当板书。
(2)教学中要有提问互动环节。
(3)教学中的实验用语言进行情景模拟。
答辩题目
1.请你说出本节课的教学目标?
2.根据质量守恒定律解释:镁在氧气中燃烧后生成物的质量比原来镁条的质量大。
在500K时将 在体积为15.0L的容器内达到下列化学平衡:
在体积为15.0L的容器内达到下列化学平衡: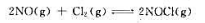 当反应在500K达到化学平衡后测得容器内NaCl的物质的量为3.06mol,计算该温度下NO的平衡物质的量和反应的标准平衡常数。
当反应在500K达到化学平衡后测得容器内NaCl的物质的量为3.06mol,计算该温度下NO的平衡物质的量和反应的标准平衡常数。


 如果结果不匹配,请
如果结果不匹配,请 
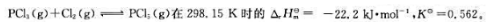 试计算上述可逆反应在473.15K时反应的标准平衡常数。
试计算上述可逆反应在473.15K时反应的标准平衡常数。
















